多家全球顶级医械公司产品召回!涉中国区销售
药监局发布公告,多家全球顶级械企主动召回问题产品
强生同月两次召回问题产品
近日,国家药监局发布公告,强生视力健商贸(上海)有限公司,对其生产的软性角膜接触镜(商品名:美瞳水凝)(注册证号:国食药监械(进)字2014第3223882号)主动召回。召回级别为二级。涉及产品在中国的销售数量为444盒,涉及生产批次为3批。
召回原因:旗下一定数量的特定批号安视优美瞳水凝(晶恬)隐形眼镜镜片存在裂口,破洞/气泡,接到用户投诉,因偶有配戴后会出现不适的症状。
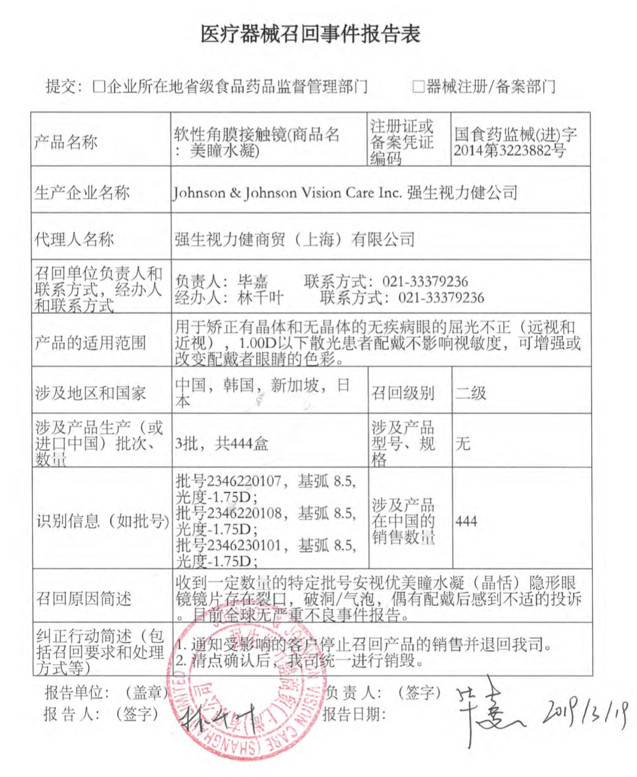
同月,在召回(商品名:美瞳水凝)的一周后,药监局再发公告,强生视力健商贸(上海)有限公司报告,公司的美国工厂Jacksonville在内部调查时,发现一个批号的安视优“欧舒适”散光部分产品没有达到额外的包装密封性测试标准,注册证编号:国食药监械(进)字2014第3224690号)主动召回。召回级别为二级。目前涉及产品在中国区销售的数量为零。
飞利浦召回存在安全隐患的X射线设备
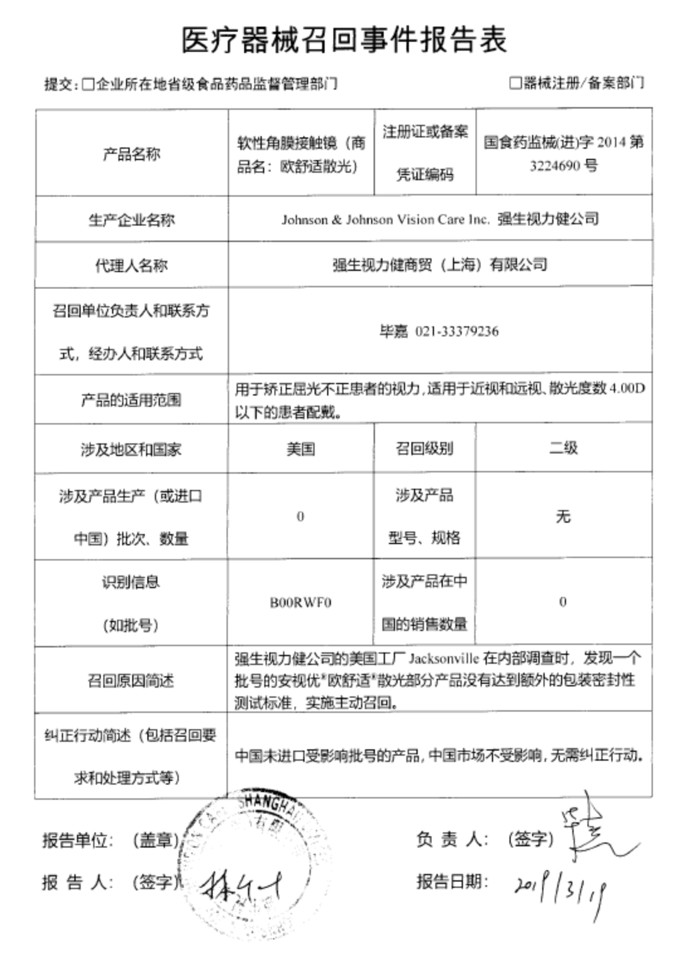
飞利浦(中国)投资有限公司在报告指出,涉及产品为了调节机架/检查床的高度和倾斜移动,系统配有2个致动器,通过4个轴与系统相连,并通过锁定板锁定每个轴的位置。在售后服务时,发现一个锁定板遗失。其中一个系统使用9年后,轴仍能正确定位。
同时,另一个系统已使用5年,轴无法正确定位,但仍能固位致动器。随着时间推移,丢失的锁定板可能导致相应连接点的轴定位不准确。如果轴完全偏离位置运作,则可能导致意外的机架/检查床倾斜移动,并且用户无法阻止,这些问题的发生将会对患者、操作者或系统附近的旁观者造成风险。
由此,飞利浦(中国)投资有限公司对其生产的X射线设备,医用X射线系统(注册证号:国食药监械(进)字2008第3303065号(更),国食药监械(进)字2004第3301731号(更))主动召回。召回级别为二级。涉及产品在中国的销售数量为36台(具体信息详见表格)。
飞利浦公司在报告表中指出,企业将通知受该问题影响的用户,并进行现场检查,确认所有可能遗失锁定版的系统。
今日,赛柏蓝器械(ID: medchina)在查询国家药品监督管理局网站时发现,3月21日至3月27日公布的医疗器械召回通知里,所涉及的问题产品目前都不涉及中国区域销售,产品未进口,企业上报相关事件到国家药监局。

(截图来源:国家药品监督管理局)
召回级别按照缺陷程度划分
赛柏蓝器械统计了,从2019年初至今的医疗器械召回事件,从中发现召回级别多数为二级,少数为三级。
国家食药监总局曾在2017年发布《医疗器械召回管理办法》。
《办法》指出,根据医疗器械缺陷的严重程度,医疗器械召回分成三级。医疗器械生产企业做出召回决定后,一级、二级、三级召回分别应在1日内、3日内、7日内,通知到有关医疗器械经营企业、使用单位或者告知使用者。《办法》于2017年5月1日开始施行。
该《办法》规定,医疗器械生产企业确定医疗器械产品存在缺陷的,应立即决定并实施召回,同时向社会发布产品召回信息。使用该医疗器械可能或者已经引起严重健康危害的,实施一级召回;可能或者已经引起暂时的、可逆的健康危害的,实施二级召回;引起危害的可能性较小但仍需要召回的,实施三级召回。实施一级召回的,召回公告应在国家食药监总局网站和中央主要媒体上发布;二级、三级召回,召回公告应在省级食品药品监管部门网站发布。









